Il Segreto Metabolico della Vita: Come l’α-Chetoglutarato Plasma le Prime Cellule Umane
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore dei primissimi istanti dello sviluppo umano, un momento carico di mistero e decisioni cruciali. Parliamo di cellule staminali embrionali umane “naive”, quelle cellule incredibilmente potenti che hanno davanti a sé un bivio fondamentale: diventare parte dell’embrione stesso (la massa cellulare interna, o ICM) oppure formare il trofoectoderma (TE), lo strato esterno che darà origine alla placenta. Capire cosa guida questa scelta è una delle grandi sfide della biologia dello sviluppo.
Per anni, abbiamo studiato i segnali chimici e i cambiamenti epigenetici (quelle modifiche al DNA che non ne alterano la sequenza ma ne influenzano l’attività) che orchestrano questo processo. Ma c’è un altro attore, forse meno appariscente ma altrettanto fondamentale, che sta emergendo con forza: il metabolismo. Sì, proprio come il nostro corpo ha bisogno di energia e mattoncini per funzionare, anche le singole cellule hanno un loro metabolismo interno complesso, e le molecole prodotte in queste reazioni possono avere ruoli inaspettati.
Una Molecola Chiave Emerge dal Metabolismo
Nel nostro laboratorio, ci siamo chiesti se ci fossero differenze metaboliche significative tra le cellule staminali naive (che mimano l’ICM) e le cellule che stanno prendendo la via del trofoectoderma. Per studiarlo, abbiamo usato un modello in vitro fantastico: le cellule staminali trofoblastiche indotte umane (hiTS), che assomigliano alle cellule del trofoectoderma che si formeranno poco dopo l’impianto dell’embrione.
Analizzando nel dettaglio le molecole presenti all’interno di questi due tipi di cellule (le nES e le hiTS), abbiamo fatto una scoperta sorprendente. Le cellule hiTS mostravano un accumulo significativo di diversi metaboliti, in particolare quelli legati alla prima parte del ciclo di Krebs (o ciclo dell’acido citrico, TCA), la centrale energetica della cellula. E tra questi, spiccava una molecola in particolare: l’α-chetoglutarato (αKG). Questo ci ha incuriosito moltissimo, perché l’αKG non è solo un intermedio metabolico, ma è noto per essere un “co-fattore” essenziale per enzimi che modificano l’epigenoma, in particolare quelli che rimuovono i gruppi metilici da DNA e istoni (le proteine attorno cui si avvolge il DNA).
Poteva essere che questo accumulo di αKG non fosse solo una conseguenza del cambiamento di identità cellulare, ma ne fosse addirittura una causa o un facilitatore? E questo avviene anche nell’embrione vero e proprio? Analizzando dati di espressione genica da embrioni umani reali, abbiamo visto che anche lì, le cellule del trofoectoderma sembrano “accendere” i geni del ciclo TCA più delle cellule dell’ICM. Il quadro iniziava a delinearsi: il metabolismo, e in particolare l’αKG, sembrava giocare un ruolo importante.
Mettere alla Prova l’α-Chetoglutarato: Un Aiuto Specifico per il Trofoectoderma
Per verificare la nostra ipotesi, siamo passati all’azione. Abbiamo preso le nostre cellule staminali naive (nES) e abbiamo provato a indurle a diventare cellule hiTS in laboratorio, ma con una piccola aggiunta: abbiamo fornito loro un extra di αKG, usando una forma modificata (dm-αKG) che può entrare facilmente nelle cellule.
I risultati sono stati sbalorditivi! Trattare le cellule con dm-αKG, anche solo per 24 ore *prima* di iniziare il processo di differenziamento verso hiTS, aumentava drasticamente l’efficienza della trasformazione. Vedevamo molte più cellule accendere i marcatori tipici del trofoectoderma (come GATA3 e CDX2) e, contemporaneamente, spegnere i marcatori della pluripotenza (come NANOG e OCT4). Non solo: il trattamento con dm-αKG riduceva anche la comparsa di cellule “indecise” che prendevano vie alternative, come quella verso il mesoderma primitivo (marcatore TBXT).

Era come se l’αKG preparasse il terreno, rendendo le cellule staminali naive più “competenti”, più pronte a rispondere ai segnali che le spingono verso il destino del trofoectoderma. Ma questa spinta era specifica? Abbiamo provato a vedere se l’αKG aiutasse anche l’altro destino possibile per le cellule naive, quello verso l’endoderma primitivo (PrE), un altro strato extra-embrionale. La risposta è stata un netto no. Anzi, il trattamento con dm-αKG sembrava addirittura ostacolare la formazione di cellule PrE. Questo ci ha confermato che l’effetto dell’αKG era sorprendentemente specifico per la linea del trofoectoderma.
Come Agisce l’αKG? Svelando il Meccanismo d’Azione
Ma come fa l’αKG a esercitare questo effetto così mirato? Ci siamo tuffati nell’analisi molecolare.
Prima di tutto, abbiamo verificato cosa succedeva a livello metabolico dentro le cellule nES trattate con dm-αKG per 24 ore. Come previsto, i livelli di αKG e di altri intermedi del ciclo TCA aumentavano. Ma abbiamo notato anche qualcos’altro di molto interessante: i livelli di acetil-CoA diminuivano. L’acetil-CoA è un’altra molecola metabolica cruciale, fondamentale perché “dona” i gruppi acetilici agli istoni, una modifica epigenetica (l’acetilazione) generalmente associata all’attivazione dei geni.
Questo ci ha portato a guardare proprio le modifiche epigenetiche. L’αKG è noto per attivare le demetilasi, enzimi che tolgono gruppi metilici. Ci aspettavamo quindi di vedere una diminuzione della metilazione, magari di quella repressiva come H3K27me3, nota per essere una barriera alla differenziazione trofoblastica. E invece… sorpresa! A livello globale, i livelli di metilazione degli istoni cambiavano pochissimo. H3K27me3 rimaneva stabile.
Cosa stava succedendo allora? Abbiamo guardato l’altra faccia della medaglia epigenetica: l’acetilazione. E qui abbiamo trovato la risposta! Il trattamento con dm-αKG causava una riduzione globale dell’acetilazione degli istoni, in particolare su un sito chiave, H3K27ac. Questo aveva senso: se diminuisce l’acetil-CoA disponibile (come avevamo visto), gli enzimi responsabili dell’acetilazione (le HATs, histone acetyltransferases) lavorano meno. Abbiamo confermato questa ipotesi con esperimenti di marcatura metabolica, dimostrando che le cellule trattate con dm-αKG depositavano meno nuovi gruppi acetilici sugli istoni.
Sembrava quindi che l’αKG agisse principalmente attraverso la riduzione dell’acetilazione istonica. Per esserne più sicuri, abbiamo provato a mimare questo effetto usando un inibitore specifico di P300, una delle principali HAT. Ebbene, inibire P300 nelle cellule nES portava a risultati molto simili a quelli ottenuti con dm-αKG: una riduzione dei geni di pluripotenza e una maggiore facilità a differenziarsi verso il trofoectoderma!

Quindi, il meccanismo sembrava essere questo: l’aumento di αKG porta a una diminuzione di acetil-CoA, che riduce l’attività delle HAT e quindi l’acetilazione degli istoni. Questa “ipoacetilazione” globale sembra indebolire la rete di geni che mantiene la pluripotenza, rendendo le cellule più suscettibili a intraprendere la via del trofoectoderma quando ricevono i segnali appropriati. L’αKG non “ordina” il cambiamento, ma lo “permette”, abbassando una barriera.
Dalla Provetta al Modello 3D: L’αKG Potenzia i Blastoidi
Le colture cellulari bidimensionali sono utili, ma volevamo vedere se l’effetto dell’αKG si mantenesse in un contesto più simile all’embrione reale. Abbiamo quindi utilizzato i blastoidi, strutture tridimensionali auto-organizzate che le cellule staminali naive possono formare in vitro e che assomigliano molto ai blastocisti umani.
Abbiamo iniziato la formazione dei blastoidi aggregando le cellule nES in piccoli pozzetti, con o senza dm-αKG. Già dopo 40 ore, abbiamo notato una differenza visibile: gli aggregati trattati con dm-αKG erano più compatti! Questo ci ha fatto pensare a un effetto sulla polarizzazione cellulare, il primo passo fondamentale per la formazione del trofoectoderma, dove le cellule esterne diventano asimmetriche.

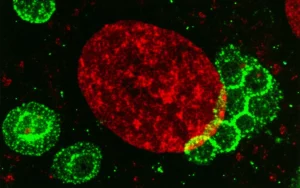
Le analisi di immunofluorescenza hanno confermato i nostri sospetti. Negli aggregati trattati con dm-αKG, la polarizzazione delle cellule esterne (visibile tramite il marcatore aPKCζ) era molto più robusta e omogenea. Questa polarizzazione è cruciale perché permette l’attivazione di YAP/TAZ, fattori di trascrizione chiave per il destino TE, solo nelle cellule esterne. E infatti, abbiamo visto che YAP/TAZ erano attivi (nucleari) in modo più definito nelle cellule esterne degli aggregati trattati, e spenti (citoplasmatici) nelle cellule interne. Sembrava che l’αKG aiutasse le cellule a “decidersi” più in fretta e in modo più coordinato.
Analizzando l’espressione genica con tecniche single-cell (scRNA-seq) in questi aggregati, abbiamo confermato che il trattamento con dm-αKG induceva cambiamenti metabolici e legati alla polarità, ma, a differenza delle colture 2D, non indeboliva significativamente la rete della pluripotenza in questa fase precoce. Tuttavia, manteneva le cellule in uno stato più “pre-impianto”, impedendo loro di progredire troppo velocemente verso stati successivi.
Maturazione Potenziata: Blastoidi più Funzionali grazie all’αKG
Abbiamo lasciato che questi aggregati si sviluppassero in blastoidi completi (fino a 5 giorni). I blastoidi derivati da aggregati pre-trattati con dm-αKG per 40 ore erano significativamente più grandi e si formavano con maggiore efficienza.
Analizzando nuovamente le cellule di questi blastoidi maturi con scRNA-seq, abbiamo fatto un’altra scoperta interessante. Mentre le cellule interne (simili all’epiblasto, Epi) erano molto simili tra controllo e trattati, le cellule esterne (simili al trofoectoderma, TE) mostravano differenze significative. Le cellule TE dei blastoidi trattati con dm-αKG esprimevano livelli più alti di geni associati al trofoectoderma polare maturo (pTE), la porzione del TE che nell’embrione reale è responsabile dell’attacco all’utero (es. NR2F2), e livelli più bassi di geni associati al trofoectoderma murale (mTE). In pratica, l’αKG non solo aiutava a formare il TE, ma ne promuoveva anche la maturazione verso lo stato funzionalmente più importante per l’impianto.

La prova finale? Abbiamo testato la funzionalità di questi blastoidi “potenziati”. Mettendoli in coltura su superfici adatte, abbiamo visto che i blastoidi pre-trattati con dm-αKG si attaccavano più efficientemente. Inoltre, quando coltivati su una matrice extracellulare tridimensionale che mima l’ambiente post-impianto, formavano strutture più grandi e mostravano una maggiore tendenza a differenziarsi ulteriormente verso tipi cellulari trofoblastici specializzati, come le cellule del sinciziotrofoblasto (SCT) e del trofoblasto extravilloso (EVT).
Conclusioni: Un Loop Metabolico per Plasmare il Destino
Quindi, cosa abbiamo imparato da questo viaggio? Abbiamo scoperto che il metabolismo, e in particolare l’α-chetoglutarato, non è un semplice spettatore passivo nei primi giorni dello sviluppo umano, ma un attore protagonista. L’αKG sembra agire come un anello di feedback positivo: il suo accumulo durante la specificazione del trofoectoderma ne rafforza ulteriormente l’identità e ne promuove la maturazione.
Il meccanismo che abbiamo svelato è affascinante: l’αKG, probabilmente attraverso la riduzione dell’acetil-CoA, modula l’epigenoma diminuendo l’acetilazione degli istoni. Questo indebolisce la pluripotenza e abbassa la soglia per l’induzione del trofoectoderma. È interessante notare come questo sia diverso da quanto osservato nel topo, dove l’αKG sembra invece stabilizzare la pluripotenza, sottolineando differenze cruciali tra le specie.
Nei blastoidi 3D, l’αKG mostra anche un sorprendente legame con la meccanica cellulare, promuovendo la polarizzazione e la compattazione iniziale. Questo suggerisce una complessa interazione tra metabolismo, epigenetica e forze fisiche nel guidare le scelte cellulari.
Queste scoperte non solo ci aiutano a capire meglio i meccanismi fondamentali dello sviluppo embrionale umano e le possibili cause di fallimento dell’impianto, ma aprono anche nuove strade per migliorare i modelli di embrioni basati su cellule staminali, rendendoli più robusti e affidabili per la ricerca. È incredibile pensare come una piccola molecola metabolica possa avere un impatto così profondo sul primissimo capitolo della nostra esistenza!
Fonte: Springer