Un Nuovo Agente PET per il Fegato? La Sorpresa dei Topi Umanizzati!
Ciao a tutti! Oggi voglio parlarvi di un’avventura scientifica affascinante, un viaggio nel mondo dell’imaging molecolare che ci ha riservato delle sorprese inaspettate. Lavoriamo nel campo della diagnostica per immagini, cercando modi sempre più precisi per “vedere” dentro il corpo umano e capire come funzionano (o non funzionano) i nostri organi. Uno degli organi più complessi e vitali è sicuramente il fegato.
Perché studiare il fegato con nuove tecniche?
Il fegato è una vera e propria centrale chimica, essenziale per tantissime funzioni. Purtroppo, è anche soggetto a molte malattie, come la fibrosi, la cirrosi, la steatosi epatica (fegato grasso), che possono progredire silenziosamente. Riuscire a diagnosticare queste condizioni precocemente, magari misurando sottili cambiamenti nella sua funzionalità, sarebbe un passo avanti enorme.
Una delle funzioni chiave del fegato è la sua capacità di “pulire” il sangue, catturando specifiche sostanze e trasportandole nella bile per eliminarle. Questo processo avviene grazie a delle “porte” molecolari sulla superficie delle cellule epatiche, chiamate trasportatori (come gli OATP e MRP2). L’idea è: se riusciamo a misurare quanto velocemente una sostanza “visibile” con le tecniche di imaging entra ed esce dal fegato, possiamo avere una misura diretta della sua funzionalità.
Finora, si è usata molto la Risonanza Magnetica (RM) con un agente di contrasto specifico per il fegato, il Gd-EOB-DTPA. Funziona, ma convertire il segnale RM in una concentrazione precisa dell’agente di contrasto è complicato e soggetto a errori. Questo limita la capacità della RM di cogliere le sfumature iniziali di una malattia epatica.
L’idea: PET al posto della RM?
Qui entriamo in gioco noi. Abbiamo pensato: e se usassimo la Tomografia ad Emissione di Positroni (PET)? La PET misura direttamente la concentrazione di un tracciante radioattivo, eliminando molte delle incertezze della RM. Potrebbe darci misure più accurate dei flussi di entrata (kinflux) e uscita (kefflux) dal fegato, permettendoci di diagnosticare le malattie epatiche prima e meglio.
Il problema era trovare il tracciante PET giusto. L’ispirazione è venuta proprio dal Gd-EOB-DTPA. La parte “EOB” (etossibenzene) di quella molecola è ciò che la rende riconoscibile dai trasportatori epatici. Senza EOB, il Gd-DTPA non entra nel fegato. Abbiamo pensato: prendiamo un “gancio” (chelante) per un isotopo PET, il NOTA, che lega molto bene il Rame-64 (64Cu, un isotopo PET con ottima risoluzione), e attacchiamoci la “chiave” EOB. Nasce così il nostro candidato: [64Cu]Cu-EOB-NOTA. Sulla carta, sembrava perfetto!
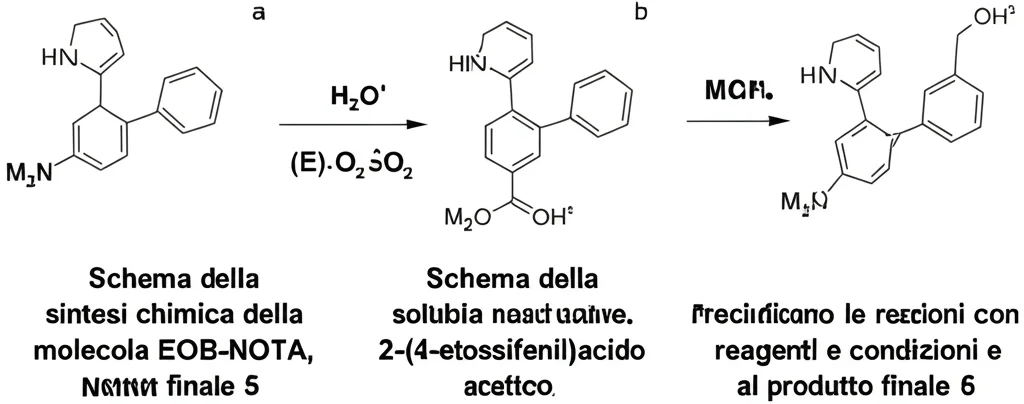
La sfida della sintesi e degli enantiomeri
Sintetizzare questa nuova molecola non è stato banale. Abbiamo seguito una serie di passaggi chimici, proteggendo e deproteggendo gruppi funzionali. Una delle complicazioni è che la molecola finale (EOB-NOTA) ha un centro chirale, cioè esiste in due forme speculari, come la mano destra e la mano sinistra, chiamate enantiomeri. Spesso, nel corpo, gli enantiomeri si comportano in modo diverso. Era fondamentale separarli (li abbiamo chiamati 6a e 6b) e testarli individualmente. Ci siamo riusciti usando una tecnica chiamata HPLC chirale sull’intermedio protetto (5a e 5b), perché separare il prodotto finale era più difficile. Poi abbiamo marcato ciascun enantiomero con il 64Cu, ottenendo i nostri traccianti PET pronti all’uso, puri e stabili.
L’esperimento: Topi normali vs. Topi “Umanizzati”
Ora veniva il bello: testare il nostro [64Cu]Cu-EOB-NOTA negli animali. Ma non in topi qualsiasi. Sappiamo che i trasportatori epatici possono essere diversi tra specie. Ad esempio, i topi trasportano bene sia Gd-BOPTA che Gd-EOB-DTPA, mentre gli umani trasportano bene solo il secondo. Per rendere i nostri risultati il più possibile predittivi per l’uomo, abbiamo usato due modelli di topo:
- Topi wild-type (WT): Topi normali, con i loro trasportatori murini (OATP1B2, OATP1A1).
- Topi “fegato-umanizzati”: Topi geneticamente modificati in cui i trasportatori epatici murini sono stati sostituiti con quelli umani (OATP1B1 e OATP1B3), espressi specificamente nel fegato. Questi topi mimano meglio la clearance epatica umana.
Abbiamo iniettato in entrambi i tipi di topi una miscela contenente sia il nostro tracciante PET ([64Cu]Cu-EOB-NOTA, uno dei due enantiomeri) sia l’agente RM Gd-EOB-DTPA (come controllo). Grazie a uno scanner speciale che fa PET e RM contemporaneamente, abbiamo seguito per un’ora dove andavano a finire le due molecole nel fegato.
Risultati: Bene nei topi, ma…
Nei topi wild-type, abbiamo visto quello che speravamo, almeno in parte. Il nostro [64Cu]Cu-EOB-NOTA veniva catturato dal fegato! Certo, l’ingresso e l’uscita erano più lenti rispetto al Gd-EOB-DTPA (che raggiungeva il picco molto prima e veniva eliminato quasi completamente in un’ora). Interessante, abbiamo notato una differenza tra i due enantiomeri: l’enantiomero B mostrava un picco di assorbimento più alto (~60% in più) e sembrava uscire leggermente più in fretta dell’enantiomero A. Quindi, nei topi normali, la molecola funzionava, anche se con dinamiche diverse dall’agente RM.
![Immagine PET/MRI del fegato di un topo wild-type che mostra l'assorbimento dell'agente [64Cu]Cu-EOB-NOTA (enantiomero B). Vista coronale, colori caldi (giallo/rosso) per alta attività PET sovrapposti a immagine MRI anatomica in scala di grigi del topo. Si vede chiaramente l'accumulo nel fegato. Obiettivo macro 100mm, alta definizione, illuminazione controllata.](https://scienzachiara.it/wp-content/uploads/2025/04/216/031_immagine-petmri-del-fegato-di-un-topo-wild-type-che-mostra-lassorbimento-dellagente-64cucu-eob-nota-enantiomero-b-vista-coronale.webp)
La Sorpresa: Il “Muro” nei Topi Umanizzati
E poi è arrivata la doccia fredda. Nei topi con i trasportatori epatici umani, il nostro [64Cu]Cu-EOB-NOTA… non entrava nel fegato. O meglio, mostrava solo un comportamento di “lavaggio” simile a quello del sangue che attraversa l’organo, senza un vero accumulo nelle cellule epatiche. Le curve di attività nel tempo erano piatte o decrescenti, molto diverse da quelle viste nei topi WT e completamente diverse da quelle del Gd-EOB-DTPA, che invece veniva trasportato efficientemente anche in questi topi umanizzati (confermando che i loro trasportatori umani erano funzionanti). Era una differenza netta, sorprendente e, diciamocelo, deludente.
Conferme Incrociate: Escrezione e Test su Cellule
Non potevamo credere solo alle immagini. Abbiamo fatto altre verifiche.
- Studi di escrezione: Abbiamo raccolto urine e feci dei topi per 20 ore dopo l’iniezione. Nei topi WT, una buona parte della radioattività (42% per A, 59% per B) finiva nelle feci, indicando un passaggio attraverso il fegato e la bile. Nei topi umanizzati, invece, quasi tutto finiva nelle urine (solo 7% per A e 12% per B nelle feci), confermando una scarsa eliminazione epatobiliare.
- Test in vitro: Abbiamo usato cellule in coltura (HEK293T) modificate per esprimere specificamente o il trasportatore murino OATP1B2 o quello umano OATP1B3. Abbiamo aggiunto il nostro [64Cu]Cu-EOB-NOTA. Risultato? Le cellule con il trasportatore murino internalizzavano la molecola circa 2.5-3 volte di più rispetto a quelle con il trasportatore umano. Bingo! Questo spiegava perfettamente i risultati visti negli animali.
Conclusioni: Una Lezione Imparata (a Caro Prezzo)
Quindi, cosa abbiamo imparato da tutta questa storia? Che il nostro [64Cu]Cu-EOB-NOTA, nonostante un design razionale basato su molecole funzionanti, non è un buon candidato per diventare un tracciante PET per valutare la funzionalità epatica negli esseri umani. La “chiave” EOB, che funziona così bene quando attaccata al Gd-DTPA, non basta quando è attaccata al Cu-NOTA per farsi riconoscere dai trasportatori umani OATP1B1/1B3, anche se viene riconosciuta da quelli murini OATP1B2.
Questa è una lezione importante:
- La biologia è complessa: Non si può sempre prevedere come una piccola modifica strutturale influenzerà l’interazione di una molecola con i sistemi biologici, specialmente quando ci sono differenze tra specie.
- L’importanza dei modelli giusti: Testare nuovi agenti diagnostici (o farmaci) in modelli animali che mimano meglio la fisiologia umana, come i topi “umanizzati” per i trasportatori epatici, è fondamentale. Ci ha permesso di capire che la nostra molecola non avrebbe funzionato nell’uomo senza dover arrivare a costosi e complessi trial clinici.
Il nostro viaggio con [64Cu]Cu-EOB-NOTA finisce qui, ma la ricerca di strumenti migliori per “vedere” il fegato e diagnosticare precocemente le sue malattie continua. Ogni esperimento, anche quelli con risultati “negativi” come questo, ci insegna qualcosa e ci avvicina all’obiettivo finale.
Fonte: Springer

![Visualizzazione 3D del fegato umano con molecole di [64Cu]Cu-EOB-NOTA (rappresentate come sfere blu) che tentano di legarsi ai trasportatori OATP (strutture proteiche incastonate nella membrana cellulare degli epatociti, in verde). Le molecole vengono respinte dai trasportatori umani, mentre sullo sfondo si intravede un modello di topo dove molecole simili (rosse) riescono a legarsi. Sfondo scientifico astratto con epatociti stilizzati. Obiettivo macro 60mm, alta definizione, illuminazione drammatica, profondità di campo ridotta.](https://scienzachiara.it/wp-content/uploads/2025/05/032_visualizzazione-3d-del-fegato-umano-con-molecole-di-64cucu-eob-nota-rappresentate-come-sfere-blu-che-tentano-di-legarsi.webp)