Il Messaggero Segreto della Fame: Come i Taniciti Parlano ai Neuroni per Controllare il Tuo Peso!
Ciao a tutti, appassionati di scienza e curiosi del corpo umano! Oggi voglio portarvi con me in un viaggio affascinante nel cuore del nostro cervello, precisamente nell’ipotalamo, la centralina che controlla funzioni vitali come… beh, la fame e il senso di sazietà. Vi siete mai chiesti come fa il cervello a sapere quando abbiamo mangiato abbastanza o quando è ora di cercare cibo? È un meccanismo incredibilmente complesso, e noi scienziati stiamo ancora scoprendo nuovi pezzi del puzzle. Recentemente, il mio team ed io abbiamo fatto una scoperta che aggiunge un tassello davvero intrigante a questa storia, svelando una comunicazione segreta tra cellule che non ti aspetteresti!
I Protagonisti Inaspettati: I Taniciti
Tutti conoscono i neuroni, le superstar del cervello. Ma c’è un altro tipo di cellula, spesso trascurata, che gioca un ruolo fondamentale: le cellule gliali. Tra queste, ci sono i taniciti, cellule specializzate che rivestono le pareti di una cavità nel cervello chiamata terzo ventricolo, proprio vicino all’ipotalamo. Immaginateli come dei “sensori” o dei “guardiani” posti in una posizione strategica. Hanno lunghe braccia (processi) che si estendono fino a toccare i neuroni chiave per il controllo dell’appetito, come i famosi neuroni AGRP/NPY (quelli che ci fanno venire una fame da lupi) e i neuroni POMC/CART (quelli che ci dicono “basta così”).
I taniciti sono bravissimi a “sentire” cosa succede nel sangue e nel liquido cerebrospinale, captando segnali come nutrienti e ormoni, e possono passare queste informazioni ai neuroni. Ma *come* comunicano esattamente? Quali messaggi si scambiano? Questo è rimasto un mistero per molto tempo.
L’Indizio: Una Proteina Misteriosa Chiamata TSPO
La nostra avventura è iniziata concentrandoci su una proteina chiamata TSPO (Translocator Protein 18 kDa), che si trova sulla membrana esterna dei mitocondri, le centrali energetiche delle cellule. Sapevamo che la TSPO era molto espressa nelle cellule gliali in certe condizioni, ma il suo ruolo specifico nel cervello, soprattutto nei taniciti, era poco chiaro. In uno studio precedente, avevamo notato che la TSPO nei taniciti sembrava essere coinvolta nelle risposte del corpo a un eccesso di nutrimento.
Così ci siamo chiesti: cosa succede se togliamo specificamente la TSPO solo dai taniciti? Potrebbe questo influenzare il modo in cui comunicano con i neuroni dell’appetito e, di conseguenza, il nostro peso corporeo e il nostro metabolismo?
L’Esperimento e i Risultati Sorprendenti
Per rispondere a questa domanda, abbiamo creato dei topi speciali (che abbiamo chiamato TanTspocKO) in cui il gene Tspo era stato “spento” selettivamente nei taniciti. Abbiamo poi messo questi topi, insieme a topi normali di controllo (TanTspoWT), a una dieta ricca di grassi (High-Fat Diet, HFD) – un po’ come simulare una situazione di eccesso calorico cronico, comune nelle nostre società.
E qui viene il bello! I topi senza TSPO nei taniciti (TanTspocKO) hanno mostrato risultati davvero notevoli rispetto ai controlli:
- Mangiavano significativamente meno.
- Guadagnavano meno peso, circa il 12% in meno!
- Avevano una massa grassa decisamente inferiore.
- Mostravano una migliore tolleranza al glucosio e sensibilità all’insulina (buone notizie per la prevenzione del diabete!).
- Bruciavano più grassi come fonte di energia.
- Avevano un dispendio energetico leggermente più alto.
Era chiaro che togliere la TSPO dai taniciti aveva un effetto “anti-obesità”. Ma perché? Analizzando l’ipotalamo di questi topi, abbiamo trovato la chiave: l’espressione dei geni Agrp e Npy (i geni che codificano per i segnali della fame nei neuroni AGRP/NPY) era significativamente più bassa nei topi TanTspocKO. Sembrava che i taniciti senza TSPO stessero inviando un segnale ai neuroni della fame per “calmarsi”.

Il Messaggio Segreto: Dall’ATP all’Adenosina
Ma quale era questo segnale? Sapevamo da studi precedenti (anche nostri!) che la mancanza di TSPO poteva aumentare i livelli di ATP (la molecola dell’energia) all’interno delle cellule. La nostra ipotesi era: forse i taniciti senza TSPO accumulano ATP e poi lo rilasciano all’esterno?
Per verificarlo, abbiamo usato una tecnica super affascinante: abbiamo inserito un gene per la luciferasi (l’enzima delle lucciole!) nei taniciti dei nostri topi, in modo che emettesse luce in presenza di ATP rilasciato all’esterno. Ebbene sì! Usando un sistema di imaging *in vivo*, abbiamo visto letteralmente che i topi TanTspocKO rilasciavano più ATP nell’ipotalamo rispetto ai controlli, specialmente dopo aver mangiato cibi grassi.
Abbiamo scoperto che questo rilascio avveniva attraverso dei canali speciali sulla membrana dei taniciti chiamati emicanali di connessina 43 (Cx43). Bloccando questi canali con un farmaco (Gap26), il rilascio di ATP diminuiva drasticamente.
Ma l’ATP rilasciato non è la fine della storia. Nello spazio tra le cellule, l’ATP viene rapidamente trasformato da una serie di enzimi (chiamati ectonucleotidasi, presenti anche sui taniciti) prima in ADP, poi in AMP e infine in adenosina. L’adenosina è una molecola molto interessante, conosciuta per i suoi effetti calmanti sul cervello (la caffeina, ad esempio, ci tiene svegli bloccando i recettori dell’adenosina!).
Abbiamo quindi misurato i livelli di adenosina fuori dalle cellule tanicitarie (usando cellule in coltura che mimavano i taniciti, le A2/29) e abbiamo confermato: quando mancava la TSPO, non solo veniva rilasciato più ATP, ma c’era anche molta più adenosina nell’ambiente extracellulare!
L’Adenosina Parla ai Neuroni della Fame
A questo punto, il quadro iniziava a delinearsi. L’ipotesi era:
1. La mancanza di TSPO nei taniciti causa un accumulo e rilascio di ATP.
2. L’ATP viene convertito in adenosina nello spazio extracellulare.
3. L’adenosina agisce come un “gliotrasmettitore” (un messaggero rilasciato da cellule gliali) sui neuroni vicini.
4. Questo messaggio di adenosina dice ai neuroni AGRP/NPY di ridurre la produzione dei segnali della fame (Agrp e Npy).
Per testare questa catena di eventi, abbiamo fatto esperimenti sia *in vitro* (usando le cellule A2/29 co-coltivate con cellule neuronali N41 che esprimono AGRP/NPY) sia *in vivo* nei nostri topi.
* Bloccando la conversione ATP -> Adenosina: Usando un inibitore delle ectonucleotidasi (ARL67156), abbiamo impedito la formazione di adenosina. Risultato? Nei topi TanTspocKO, questo trattamento annullava la riduzione dell’assunzione di cibo e l’abbassamento dei livelli di Agrp e Npy. Questo confermava che era proprio l’adenosina (e non l’ATP stesso in questo contesto) a causare l’effetto anoressizzante (riduzione dell’appetito).
* Identificando il Recettore: L’adenosina agisce legandosi a specifici recettori. Abbiamo scoperto che i neuroni AGRP/NPY esprimono prevalentemente il recettore dell’adenosina di tipo 1 (A1R). Bloccando specificamente A1R (con un farmaco chiamato DPCPX) nei topi TanTspocKO, abbiamo nuovamente invertito gli effetti: i topi ricominciavano a mangiare di più e i livelli di Agrp e Npy risalivano.
* Conferma Finale: Per essere sicurissimi, abbiamo usato una tecnica genetica (AAV virali) per “spegnere” il recettore A1R specificamente solo nei neuroni AGRP/NPY dei topi. Quando abbiamo poi iniettato adenosina direttamente nell’ipotalamo di questi topi, abbiamo visto che l’effetto di riduzione dell’appetito era completamente perso! Questo dimostrava in modo inequivocabile che l’adenosina agisce proprio tramite A1R su questi neuroni per controllare la fame.

Il Meccanismo a Valle: Come l’Adenosina Spegne la Fame
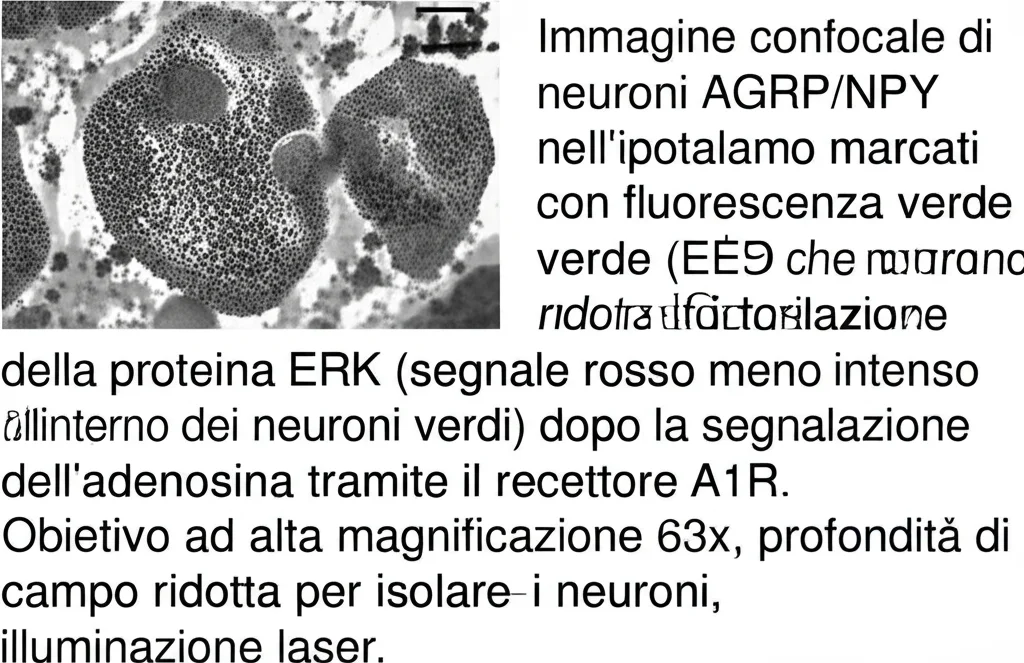
Ok, l’adenosina si lega ad A1R sui neuroni AGRP/NPY. Ma cosa succede *dentro* questi neuroni? Come fa questo legame a ridurre l’espressione di Agrp e Npy? Abbiamo indagato le vie di segnalazione intracellulare e abbiamo scoperto che l’attivazione di A1R da parte dell’adenosina porta a una riduzione della fosforilazione (cioè dell’attivazione) di una proteina chiave chiamata ERK (Extracellular-signal-regulated kinase). La via ERK è nota per essere coinvolta nella regolazione dell’espressione genica. Inibendo ERK, abbiamo visto che l’espressione di Agrp e Npy diminuiva, mimando l’effetto dell’adenosina.
Quindi, il percorso completo che abbiamo svelato è:
Taniciti (senza TSPO) -> Rilascio ↑ ATP (via Cx43) -> Conversione ↑ Adenosina (extracellulare) -> Legame Adenosina a A1R (su neuroni AGRP/NPY) -> Attivazione ↓ ERK -> Espressione ↓ Agrp/Npy -> Riduzione Appetito e Peso Corporeo.
Cosa Significa Tutto Questo?
Questa scoperta è entusiasmante per diversi motivi. Prima di tutto, svela un meccanismo completamente nuovo di comunicazione tra taniciti e neuroni AGRP/NPY, fondamentale per regolare l’omeostasi energetica (l’equilibrio tra energia assunta ed energia spesa). Dimostra che i taniciti non sono solo spettatori passivi, ma partecipano attivamente inviando segnali specifici (in questo caso, l’adenosina) che influenzano direttamente il nostro comportamento alimentare.
In secondo luogo, identifica l’adenosina come un gliotrasmettitore anoressizzante in questo specifico circuito ipotalamico. Mentre l’ATP rilasciato potrebbe avere altri ruoli (forse anche opposti, stimolando l’appetito tramite altri recettori, come suggerito da altri studi e dai nostri dati non mostrati qui), in questa condizione specifica (mancanza di TSPO e dieta grassa), è la sua conversione in adenosina ad avere l’effetto dominante di riduzione della fame.
Infine, apre potenziali nuove strade terapeutiche. Capire come modulare questa via di segnalazione tanycita-neurone potrebbe un giorno aiutarci a sviluppare nuove strategie per combattere l’obesità e i disturbi metabolici correlati, come il diabete di tipo 2. Magari potremmo trovare modi per potenziare questo segnale di “stop alla fame” mediato dall’adenosina?
Certo, siamo ancora all’inizio. Dobbiamo capire meglio come la TSPO regola i livelli di ATP nei taniciti e se questo meccanismo è attivo anche in condizioni fisiologiche normali o solo in risposta a stress metabolici come una dieta ricca di grassi. Ma ogni scoperta ci avvicina un po’ di più a comprendere la straordinaria complessità del nostro cervello e del nostro corpo.
È stato un viaggio incredibile finora, e non vediamo l’ora di scoprire cosa ci riserva il futuro in questo campo di ricerca! Spero che questa immersione nel mondo dei taniciti e dell’adenosina vi abbia affascinato quanto affascina noi ogni giorno in laboratorio.
Fonte: Springer







