Chimica Controintuitiva: Quando l’Addizione Ossidativa… Diventa Riduttiva!
Ciao a tutti, appassionati di chimica e curiosi! Oggi voglio parlarvi di qualcosa che mi ha davvero fatto riflettere su come diamo per scontate certe “regole” nel nostro campo. Parliamo di reazioni fondamentali, quelle che trovate sui libri di testo, come l’addizione ossidativa. Un classico, no? Un centro metallico reagisce con una molecola, rompe un legame in essa e, nel processo, aumenta il suo stato di ossidazione formale. Pensate all’idrogenazione catalitica: un metallo reagisce con H₂, rompe il legame H-H, forma due legami M-H e passa, ad esempio, da uno stato di ossidazione 0 a +2. Semplice, lineare, ossidativo per il metallo.
Questo concetto si basa sull’idea che gli atomi con cui il metallo si lega (idrogeno, carbonio, alogeni…) siano più elettronegativi del metallo stesso. Ma cosa succederebbe se invertissimo le parti? Se il metallo fosse *più* elettronegativo degli atomi che si aggiungono? Potremmo ancora chiamarla addizione ossidativa? O forse dovremmo parlare di… addizione riduttiva?
Una Molecola Speciale e i Suoi Partner Inaspettati
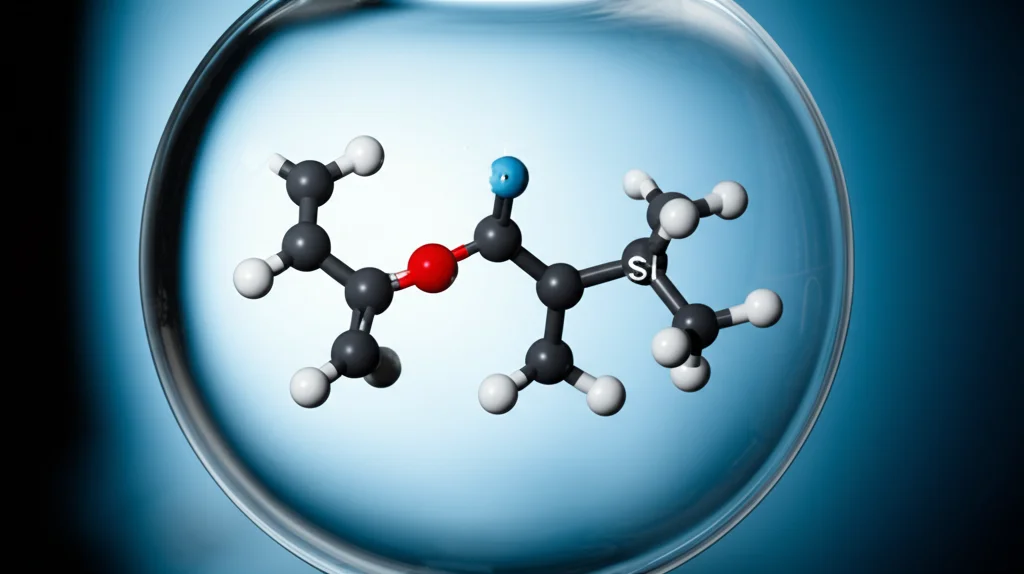
Ecco dove entra in gioco il protagonista della nostra storia: un complesso con un legame diretto zinco-zinco, chiamato Cp*ZnZnCp* (dove Cp* è un gruppo ingombrante che aiuta a stabilizzare la molecola). Pensate a questa molecola come a una “cugina” più pesante dell’idrogeno (H₂). Entrambe hanno un legame σ e un orbitale σ* antilegante, ma nello zinco-zinco sono coinvolti orbitali atomici diversi (4s invece di 1s).
Abbiamo deciso di vedere come questa molecola di dizinco reagisce con una serie di composti chiamati “analoghi dei carbeni del gruppo principale”. Si tratta di molecole con elementi come il silicio (Si), l’alluminio (Al), il gallio (Ga) o l’indio (In) in uno stato di ossidazione basso e con una coordinazione due, un po’ come i carbeni organici ma con elementi più pesanti. Ci aspettavamo forse un’interazione, ma quello che abbiamo osservato è stato sorprendente.
Rompere il Legame Zn-Zn: Un Nuovo Tipo di Addizione
Facendo reagire Cp*ZnZnCp* con gli analoghi del carbene a base di silicio, alluminio e gallio, abbiamo visto accadere qualcosa di netto: il legame zinco-zinco si rompe completamente! Al suo posto, si formano due nuovi legami tra l’elemento del gruppo principale (Si, Al, Ga) e ciascuno degli atomi di zinco. Il risultato? L’atomo centrale (Si, Al, Ga) passa da una coordinazione due a una coordinazione quattro, assumendo una geometria approssimativamente tetraedrica.
Abbiamo isolato e caratterizzato questi nuovi composti (chiamiamoli 2a per il silicio, 2b per l’alluminio e 2c per il gallio). Le analisi strutturali ai raggi X hanno confermato la geometria tetraedrica e, soprattutto, hanno mostrato che i due atomi di zinco sono ora molto distanti tra loro (oltre 4 Å), ben oltre la distanza di un legame. Il legame Zn-Zn è decisamente spezzato.
Curiosamente, nel caso del gallio (2c), la reazione è reversibile. A temperatura ambiente si forma un equilibrio, ma raffreddando la miscela, l’equilibrio si sposta completamente verso il prodotto di addizione. Questo ci dice che la reazione è termodinamicamente favorita, ma non in modo schiacciante, e che anche il processo inverso (l’eliminazione riduttiva, se vogliamo) è accessibile. Con l’indio (In), la faccenda si è complicata ulteriormente: il prodotto di addizione iniziale (2d) è troppo instabile e reagisce ulteriormente per formare una catena di quattro atomi metallici Zn-In-In-Zn.

Ma è Ossidativa o Riduttiva? La Questione dell’Elettronegatività
E qui torniamo alla domanda iniziale. Secondo la definizione ufficiale IUPAC, lo stato di ossidazione si assegna dividendo i legami e attribuendo gli elettroni all’atomo più elettronegativo (usando la scala di Allen). Ora, guardiamo le elettronegatività: lo zinco (Zn) ha un valore di 1.59. Gli altri elementi coinvolti sono: silicio (Si, 1.92), alluminio (Al, 1.61), gallio (Ga, 1.76) e indio (In, 1.66).
Vedete? In tutti questi casi, l’elemento del gruppo principale (Si, Al, Ga, In) è *più* elettronegativo dello zinco! Quindi, se seguiamo la definizione alla lettera, quando si formano i legami E-Zn (E = Si, Al, Ga, In), gli elettroni di legame vengono formalmente assegnati a E. Questo significa che l’elemento E *guadagna* formalmente elettroni, subendo una riduzione, mentre lo zinco li perde, ossidandosi. Dal punto di vista dell’elemento E che subisce l’addizione, questa è formalmente una addizione riduttiva!
Certo, la chimica ama le sfumature. La differenza di elettronegatività tra Al e Zn è minima (0.02), quasi trascurabile. Per Al, Ga e In, potremmo discutere se sia più corretto parlare di processo redox neutro (un’inserzione). Ma per il silicio, la differenza è netta (1.92 vs 1.59) indipendentemente dalla scala di elettronegatività che usiamo. Il caso dell’addizione a un centro di silicio(II) sembra davvero rappresentare un prototipo di addizione riduttiva.
Cosa Ci Dicono i Calcoli Computazionali?
Per capirci di più, ci siamo tuffati nei calcoli teorici (DFT). Questi hanno confermato il meccanismo di reazione, che passa attraverso un intermedio e uno stato di transizione a tre centri, simile a quello delle addizioni ossidative classiche, ma con conseguenze redox diverse.
Abbiamo analizzato la natura dei nuovi legami E-Zn formati. Metodi come AIM (Atoms in Molecules) e IGMH (Independent Gradient Model based on Hirshfield partition) non mostrano alcuna interazione residua significativa tra i due atomi di zinco nei prodotti, confermando la rottura del legame Zn-Zn. Indicano invece la presenza di legami covalenti, seppur deboli, tra E e Zn.
L’analisi delle cariche atomiche (come NPA – Natural Population Analysis) e degli orbitali molecolari localizzati (NLMO) suggerisce che nei prodotti 2a-2c, la densità elettronica si accumula sull’atomo centrale E (Si, Al, Ga), mentre i centri di zinco diventano le specie più elettropositive. I legami E-Zn sono polari, con la carica negativa parziale sull’elemento E. Questo è l’opposto di quanto ci si aspetterebbe in un’addizione ossidativa classica (come l’addizione di H₂), dove il centro metallico si impoverisce di elettroni e gli idrogeni diventano idruri (H⁻).

Questa polarizzazione suggerisce che l’atomo centrale E nei prodotti dovrebbe essere nucleofilo. E infatti, abbiamo provato a far reagire il composto di alluminio 2b con ioduro di metile (MeI). Il risultato principale è stata la formazione di un composto di dimetilalluminio e Cp*ZnI, indicando che l’attacco è avvenuto proprio sul centro di alluminio, confermando la sua natura nucleofila.
Un Continuum di Possibilità Redox
Cosa ci insegna tutto questo? Che forse dovremmo essere più cauti nell’etichettare ciecamente le reazioni di addizione come “ossidative”. La definizione formale IUPAC, basata sull’elettronegatività, porta in questo caso a descrivere queste reazioni come addizioni riduttive. L’analisi elettronica dettagliata rivela un quadro più sfumato, dove probabilmente esiste un continuum di esiti redox che vanno dall’ossidativo, al redox neutro, fino al riduttivo.
Questo concetto non è limitato ai composti del gruppo principale. Calcoli su complessi di nichel con leganti di zinco suggeriscono scenari simili anche per i metalli di transizione. Recentemente è stata descritta anche l’addizione di legami Be-Be al nichel come “addizione riduttiva”.
Questi risultati evidenziano i limiti del nostro linguaggio scientifico “normativo”. Invece di fossilizzarci su etichette rigide, forse dovremmo considerare questo spettro di possibilità. E in casi particolari, come l’addizione del nostro complesso di dizinco a un sililene che abbiamo studiato, il termine addizione riduttiva sembra non solo formalmente corretto, ma anche concettualmente appropriato. È un piccolo promemoria che la chimica ha sempre nuovi modi per sorprenderci e sfidare le nostre convenzioni!
Fonte: Springer