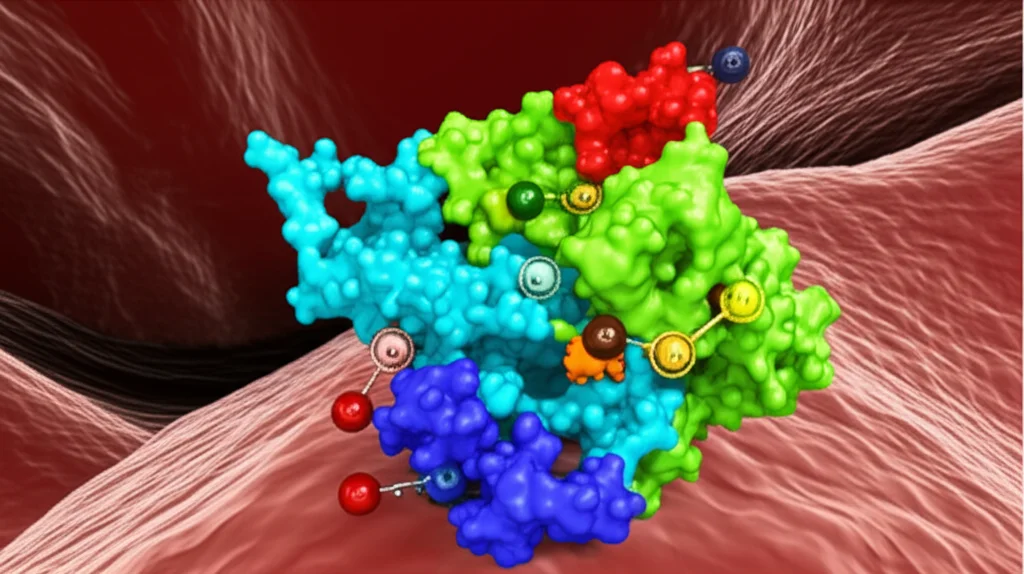
DnaK di Actinobacillus seminis: La Chiave Nascosta per l’Acquisizione del Ferro dall’Ospite
Amici appassionati di scienza, preparatevi per un’avventura nel mondo microscopico, dove batteri astuti mettono in atto strategie sorprendenti per sopravvivere e prosperare! Oggi vi parlerò di un microrganismo chiamato Actinobacillus seminis, un tipetto che, purtroppo, non è famoso per buone azioni. È infatti una delle cause principali dell’epididimite ovina, una fastidiosa malattia infettiva che può portare ad atrofia testicolare, bassa fertilità e persino sterilità negli animali colpiti. Un bel problema per gli allevatori e, naturalmente, per le povere pecore.
Ora, dovete sapere che per quasi tutti gli esseri viventi, dai microbi più piccoli fino a noi esseri umani, c’è un elemento che è assolutamente cruciale per la vita: il ferro. Questo microelemento è come l’olio per un motore: senza di esso, molte funzioni vitali semplicemente si inceppano. Immaginatevelo coinvolto nella produzione di energia, nella replicazione del DNA, insomma, in un sacco di processi fondamentali. Per i batteri patogeni, la capacità di “rubare” il ferro all’ospite che infettano è spesso un fattore di virulenza determinante, una vera e propria arma segreta.
Il Mistero dell’Acquisizione del Ferro in A. seminis
Nonostante la sua importanza, i meccanismi con cui A. seminis si procura il ferro sono rimasti a lungo un mistero. Come fa questo batterio a ottenere questo nutriente essenziale quando si trova all’interno dell’ospite? È proprio per rispondere a questa domanda che è stato condotto uno studio affascinante, i cui risultati voglio condividere con voi.
I ricercatori hanno iniziato mettendo A. seminis “a dieta di ferro”, coltivandolo in un terreno di coltura dove questo elemento scarseggiava, grazie all’aggiunta di una sostanza chiamata 2,2′-dipiridile, che è un chelante del ferro (cioè lo “sequestra”). Ebbene, in queste condizioni di carenza, la crescita del batterio si è ridotta di circa il 40%. Però, bastava aggiungere un po’ di cloruro ferrico (FeCl3) e voilà, la crescita riprendeva alla grande! Questo ci dice chiaramente quanto il ferro sia indispensabile per lui.
Una delle strategie più comuni che i batteri usano per accaparrarsi il ferro è la produzione di siderofori. Pensateli come delle piccole molecole specializzate che vanno a caccia di ferro nell’ambiente, lo legano strettamente e poi lo trasportano all’interno della cellula batterica. Sorprendentemente, i test effettuati (il saggio CAS-BHI, per i più tecnici) hanno indicato che A. seminis non sembra produrre siderofori propri. Un po’ come un ladro che non ha gli strumenti per scassinare la cassaforte, ma forse ha altri assi nella manica!
DnaK: Un Protagonista Inaspettato
Analizzando le proteine espresse dal batterio in condizioni normali e in carenza di ferro, è emersa una figura chiave: una proteina di circa 70 kDa. Grazie alla spettrometria di massa, questa proteina è stata identificata come DnaK. Ora, DnaK è una proteina chaperon, una sorta di “assistente molecolare” che aiuta altre proteine a ripiegarsi correttamente e a funzionare bene, ed è anche una proteina da shock termico. Ma cosa c’entra con il ferro?
Qui arriva il bello! Si è scoperto che questa proteina DnaK di A. seminis è in grado di interagire specificamente con importanti proteine dell’ospite che legano il ferro: la transferrina bovina, la lattoferrina bovina e l’emoglobina bovina. È come se DnaK fosse una calamita che si attacca solo a queste proteine quando sono “cariche” di ferro. Infatti, l’interazione non avveniva con le versioni “scariche” (apo-transferrina e apo-lattoferrina). Questo suggerisce fortemente che DnaK giochi un ruolo diretto nell’acquisizione del ferro da queste fonti dell’ospite.
Curiosamente, l’espressione di DnaK diminuiva in condizioni di restrizione di ferro a 37 °C, ma rimaneva invariata a 40 °C. Considerando che la temperatura corporea normale di una pecora è intorno ai 39-40 °C, e che l’epididimo ha una temperatura leggermente inferiore, questo comportamento potrebbe avere un significato biologico preciso nel contesto dell’infezione.
Altre Strategie e Proteine Coinvolte
Ma DnaK non è l’unica carta che A. seminis si gioca. Quando il batterio è stato coltivato in carenza di ferro, ha sovra-espresso tre proteine (tra cui una proteina legante la transferrina) e ne ha sotto-espresso altre sette (principalmente enzimi e presunte adesine). Questo ci dice che il batterio riorganizza attivamente il suo macchinario molecolare per far fronte alla scarsità di questo nutriente vitale.
Un’analisi in silico (cioè al computer, analizzando il genoma del batterio) ha rivelato la presenza di geni che codificano per recettori di siderofori e trasportatori di siderofori. Anche se A. seminis non produce siderofori propri, potrebbe essere in grado di “rubare” quelli prodotti da altri microrganismi presenti nello stesso ambiente. Una sorta di parassitismo del ferro! Molti membri della famiglia delle Pasteurellaceae (a cui A. seminis appartiene) sono noti per questa capacità di utilizzare siderofori altrui o di prelevare ferro direttamente dalle proteine dell’ospite senza produrre siderofori.
È interessante notare che il siero di pecore affette da epididimite riconosceva la proteina DnaK, indicando che questa proteina viene espressa in vivo durante l’infezione e che il sistema immunitario dell’ospite la “vede”. Non solo, DnaK ha mostrato anche la capacità di interagire con la fibronectina e il fibrinogeno bovini, suggerendo un possibile ruolo anche come adesina, cioè una proteina che aiuta il batterio ad attaccarsi ai tessuti dell’ospite. Le proteine DnaK sono note per essere proteine “moonlighting”, ovvero proteine con più di una funzione, e questa sembra essere una di quelle!
Implicazioni e Conclusioni: Un Batterio Pieno di Risorse
Cosa ci insegna tutto questo? Ci dice che Actinobacillus seminis è un batterio piuttosto scaltro e pieno di risorse quando si tratta di procurarsi il ferro. Sembra preferire una strategia “economica”, utilizzando proteine già impiegate per altre funzioni, come la chaperon DnaK (e forse anche GroEL, un’altra chaperonina precedentemente descritta come emagglutinina in questo batterio), per interagire con le fonti di ferro dell’ospite.
L’interazione di DnaK con transferrina, lattoferrina ed emoglobina cariche di ferro, ma non con le loro forme apo (prive di ferro), è un indizio fortissimo del suo coinvolgimento diretto nel processo di acquisizione. Immaginate DnaK come una sorta di “gancio” che afferra queste proteine ricche di ferro e le avvicina alla cellula batterica, dove altri meccanismi (come la proteina TbpB, anch’essa identificata) possono poi estrarre il prezioso metallo.
Anche se non produce siderofori, la presenza di geni per i loro recettori e trasportatori suggerisce che possa approfittare di quelli prodotti da altri batteri. Insomma, A. seminis sembra avere un arsenale diversificato di meccanismi per l’acquisizione del ferro, il che potrebbe spiegare la sua capacità di infettare con successo diversi tessuti dell’ospite.
Capire a fondo questi meccanismi non è solo una curiosità scientifica. È fondamentale perché ci potrebbe fornire nuovi bersagli per sviluppare strategie di controllo contro l’epididimite ovina. Se riusciamo a bloccare l’acquisizione del ferro da parte di A. seminis, potremmo renderlo molto meno capace di causare la malattia.
Quindi, la prossima volta che penserete al ferro, non limitatevi agli spinaci di Braccio di Ferro! Ricordatevi che nel mondo microscopico si combattono vere e proprie guerre per questo elemento, e batteri come Actinobacillus seminis hanno evoluto strategie incredibilmente sofisticate, come l’uso della versatile proteina DnaK, per assicurarsi la loro dose quotidiana. La ricerca continua, e chissà quali altri segreti ci svelerà questo affascinante microrganismo!
Fonte: Springer