Acin1: Essenziale per la Vita Embrionale, Ma un Ruolo Sottile nel Muscolo
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante che succede dentro le nostre cellule, un processo chiamato splicing alternativo. Immaginate il nostro DNA come un’enorme enciclopedia e i geni come i singoli volumi. Prima che le istruzioni di un volume (gene) possano essere usate per costruire qualcosa (una proteina), devono essere trascritte in un messaggio più maneggevole, l’RNA. Ma questo messaggio spesso contiene parti inutili (introni) che devono essere tagliate via, e le parti utili (esoni) devono essere ricucite insieme. Lo splicing è proprio questo: taglia e cuci. E lo splicing *alternativo*? Beh, è come se da uno stesso volume potessimo creare diverse versioni del messaggio, magari saltando qualche capitolo o usandone uno alternativo, per costruire proteine leggermente diverse con funzioni specifiche. Un meccanismo incredibilmente potente e versatile!
Ora, chi dirige questo complesso lavoro di sartoria molecolare? Ci sono tante proteine coinvolte, e tra queste c’è la protagonista della nostra storia: Acin1. Questa proteina, nota anche come Acinus, è una legatrice di RNA (RNA-binding protein) ed è sospettata da tempo di avere un ruolo nello splicing. Ma cosa fa *davvero* Acin1 nel grande schema della vita? È quello che abbiamo cercato di scoprire.
Un Ruolo Vitale Fin dal Principio
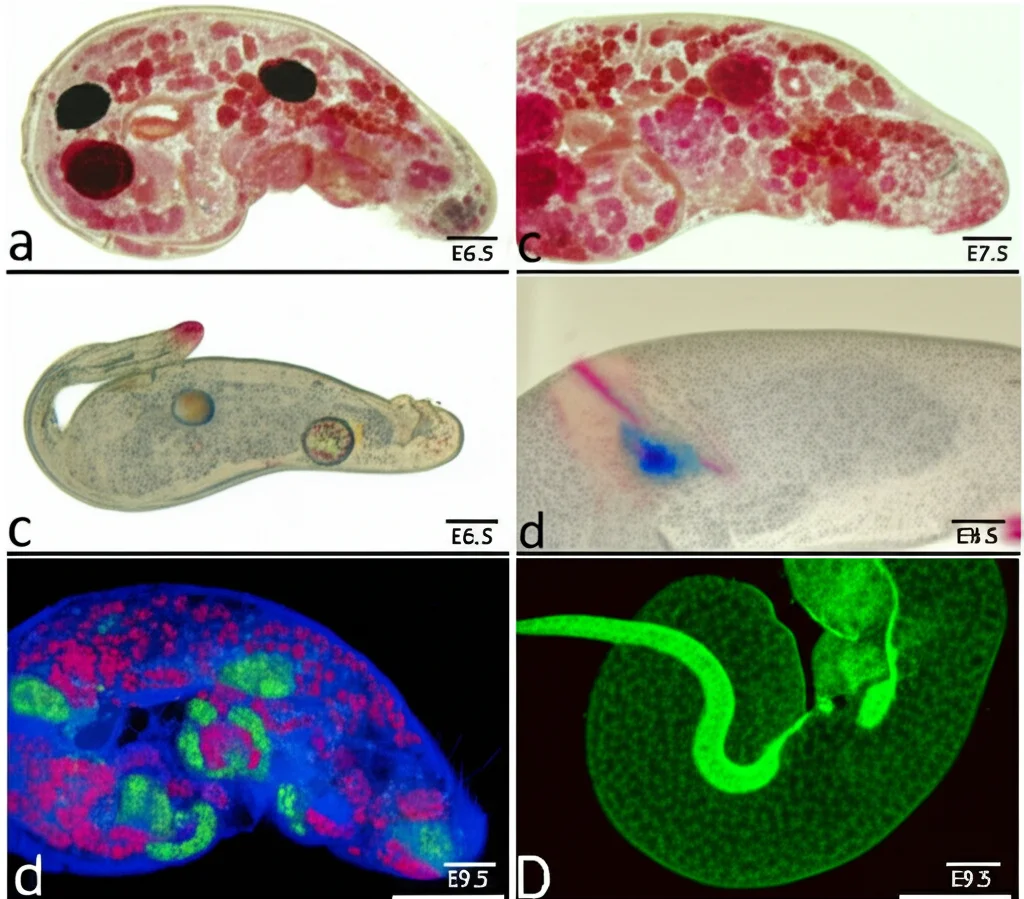
Per capire la funzione di un gene, una strategia classica è vedere cosa succede quando lo si “spegne”. Così, abbiamo creato dei topi geneticamente modificati in cui il gene Acin1 era completamente assente (knockout globale). Il risultato? Un vero dramma. Questi topolini non riuscivano a superare una fase precoce dello sviluppo embrionale, morendo intorno all’undicesimo giorno e mezzo di gestazione (E11.5). Gli embrioni senza Acin1 mostravano chiari segni di ritardo nello sviluppo ed erano più piccoli dei loro fratelli sani già a E6.5-E7.5.
Abbiamo indagato più a fondo: forse le cellule si dividevano meno? O morivano di più? Utilizzando tecniche specifiche (BrdU per la proliferazione e TUNEL per l’apoptosi, ovvero la morte cellulare programmata), abbiamo scoperto che il problema non era tanto una ridotta divisione cellulare, quanto un aumento significativo dell’apoptosi. Senza Acin1, troppe cellule andavano incontro a morte programmata, compromettendo lo sviluppo dell’intero organismo. Questo ci ha detto una cosa fondamentale: Acin1 è assolutamente essenziale per la vita embrionale. Senza di lei, semplicemente, non si va avanti.
Acin1 nel Muscolo: Una Presenza Discreta ma Importante
Ok, Acin1 è vitale per l’embrione. Ma cosa succede nei tessuti specifici una volta che l’organismo si è sviluppato? Ci siamo concentrati sul muscolo scheletrico, un tessuto dove lo splicing alternativo è particolarmente attivo e importante per generare la diversità di proteine necessarie al suo funzionamento. Prima di tutto, abbiamo verificato dove si trovasse Acin1 nel muscolo adulto: sorpresa! Era abbondante nei nuclei delle fibre muscolari, molto più che nelle cellule satellite (le cellule staminali del muscolo) o nelle altre cellule presenti tra le fibre. Sembrava proprio avere un ruolo lì dentro.
A questo punto, abbiamo usato una strategia più raffinata: il knockout *condizionale*. Invece di eliminare Acin1 ovunque, l’abbiamo spenta specificamente solo nelle fibre muscolari scheletriche mature (usando un sistema chiamato Cre-Lox con un promotore muscolo-specifico, HSA-Cre). E qui le cose si sono fatte interessanti. Questi topi (li abbiamo chiamati Acin1 MKO, Muscle Knockout) erano vitali, fertili e a prima vista indistinguibili dai loro compagni di cucciolata sani. Niente morte embrionale, niente problemi evidenti.
Ma guardando più da vicino il loro tessuto muscolare, abbiamo notato delle differenze. Le fibre muscolari dei topi MKO erano significativamente più grandi (ipertrofia) e i muscoli pesavano di più rispetto al peso corporeo totale. Però, attenzione: nonostante muscoli più grossi, la loro forza (misurata con un test di presa, il grip strength test) non era aumentata! Un po’ come dire “tutto fumo e niente arrosto?”.
Danno e Rigenerazione Continua
Scavando ancora più a fondo nell’istologia muscolare, abbiamo trovato altri indizi. I muscoli dei topi MKO mostravano segni di danno e rigenerazione continui. Come lo sappiamo?
- Un numero maggiore di fibre muscolari aveva i nuclei posizionati al centro, invece che alla periferia come nel muscolo sano e maturo. La presenza di nuclei centrali è un classico segno di rigenerazione muscolare in corso, spesso in risposta a un danno.
- Abbiamo trovato aree più estese positive per la catena pesante della miosina embrionale (eMyHC), un’altra proteina tipica delle fibre muscolari in fase di rigenerazione.
- Utilizzando un colorante speciale (Evans Blue Dye, EBD) che entra solo nelle cellule con membrane danneggiate, abbiamo visto che molte più fibre muscolari nei topi MKO erano permeabili al colorante, indicando una maggiore fragilità e danno della membrana.
- Anche l’apoptosi (morte cellulare) era aumentata nei nuclei all’interno delle fibre muscolari MKO.
Inoltre, abbiamo osservato che questi segni di danno e rigenerazione peggioravano con l’età: nei topi MKO anziani (90 settimane), la percentuale di fibre con nuclei centrali era ancora più alta rispetto ai topi giovani (12 settimane). Tutto questo suggerisce che, sebbene Acin1 non sia indispensabile per la *formazione* del muscolo, gioca un ruolo importante nel mantenerlo sano e integro nel tempo (omeostasi muscolare). La sua assenza rende le fibre più suscettibili al danno, innescando un ciclo continuo di degenerazione e rigenerazione compensatoria.

Sotto il Cofano: Espressione Genica e Splicing Sregolati
Ma qual è il meccanismo molecolare dietro questi effetti? Per capirlo, abbiamo analizzato l’RNA messaggero presente nei muscoli dei topi MKO e li abbiamo confrontati con quelli dei topi di controllo (RNA-seq). Abbiamo trovato due tipi principali di alterazioni:
1. Cambiamenti nell’espressione genica: Circa 400 geni avevano livelli di espressione significativamente diversi tra MKO e controlli. Molti geni sovraregolati (cioè più espressi) nei topi MKO erano legati alla contrazione muscolare, allo sviluppo e alla differenziazione. Questo potrebbe essere un tentativo del muscolo di compensare il danno promuovendo l’ipertrofia che abbiamo osservato.
2. Cambiamenti nello splicing alternativo: Essendo Acin1 un fattore di splicing, ci aspettavamo di trovare alterazioni qui. E infatti! Usando software specifici (rMATS e CASH), abbiamo identificato centinaia di eventi di splicing alternativo che erano diversi nei topi MKO. Il tipo più comune di alterazione era il “salto dell’esone” (skipped exon o cassette exon), dove un particolare esone veniva incluso o escluso più o meno frequentemente rispetto al normale.
Analizzando i geni colpiti da questi errori di splicing, abbiamo visto che molti erano coinvolti nello sviluppo strutturale del muscolo, nella segnalazione cellulare e nel metabolismo. In particolare, abbiamo esaminato più da vicino cinque geni con splicing alterato: Fxr1, Itga7, Sgcg, Card19 e Mief2. I primi tre sono noti per essere coinvolti in miopatie e distrofie muscolari, mentre gli ultimi due hanno a che fare con la funzione dei mitocondri (le centrali energetiche della cellula).
Cosa succedeva a questi geni? In Fxr1 e Itga7, le alterazioni di splicing portavano a un aumento delle isoforme proteiche tipiche del muscolo immaturo o indifferenziato. Ad esempio, in Itga7, veniva saltato più spesso un esone (il 26) che normalmente è presente nel muscolo maturo. Questo è interessante perché proprio l’espressione di isoforme “sbagliate” o immature è stata collegata ad alcune forme di distrofia muscolare. In altri geni come Mief2, l’alterazione dello splicing introduceva un segnale di stop prematuro, probabilmente portando alla degradazione dell’RNA e all’assenza della proteina corrispondente. Abbiamo confermato queste modifiche di splicing usando un’altra tecnica (RT-PCR).
Quindi, sembra che l’assenza di Acin1 nel muscolo non causi un disastro immediato, ma “sregoli” finemente sia l’espressione che, soprattutto, lo splicing di geni cruciali per la funzione e la manutenzione muscolare, portando nel tempo a una maggiore fragilità e a un tentativo continuo (ma non del tutto efficace) di riparazione.

Cosa Abbiamo Imparato e Cosa Resta da Capire
Questo studio ci ha insegnato molto su Acin1. Abbiamo confermato senza ombra di dubbio che è fondamentale per lo sviluppo embrionale. Abbiamo anche scoperto che, pur non essendo catastrofica la sua assenza nel muscolo adulto, essa provoca comunque problemi significativi all’omeostasi del tessuto, rendendolo più fragile e soggetto a danno, probabilmente a causa della sua incapacità di regolare correttamente lo splicing alternativo di geni chiave. È affascinante vedere come lo stesso fattore possa avere ruoli così diversi: vitale in una fase, più “di mantenimento” in un’altra.
Certo, come ogni ricerca, anche questa ha i suoi limiti. Ad esempio, abbiamo usato tecniche potenti ma non perfette per analizzare lo splicing, e non abbiamo potuto verificare tutte le conseguenze a livello proteico. Inoltre, le analisi funzionali del muscolo erano limitate. Studi futuri, magari usando tecniche di sequenziamento più avanzate o analisi funzionali più complete, potranno darci un quadro ancora più dettagliato. Il modello di topo che abbiamo creato (Acin1 Flox) sarà uno strumento prezioso per esplorare il ruolo di Acin1 anche in altri tessuti.
In conclusione, Acin1 si rivela un attore cruciale nella regolazione genica post-trascrizionale. Indispensabile per iniziare la vita, continua poi a svolgere un ruolo, seppur più limitato ma non trascurabile, nel mantenere in salute tessuti complessi come il muscolo scheletrico, assicurandosi che il delicato processo di splicing alternativo funzioni a dovere. Un piccolo ingranaggio, forse, ma essenziale per la perfetta sinfonia della biologia.
Fonte: Springer