Acido Gallico: Lo Scudo Verde Rivoluzionario Contro la Corrosione dell’Acciaio!
Ciao a tutti! Oggi voglio parlarvi di una sfida enorme che affrontiamo in molti settori industriali, specialmente in quello petrolifero: la corrosione. Immaginate tubature, serbatoi, attrezzature costosissime esposte ad ambienti aggressivi, come l’acido cloridrico (HCl), che giorno dopo giorno vengono letteralmente “mangiati” da questo processo chimico subdolo. Non solo si rischiano danni economici ingenti per la sostituzione dei materiali, ma anche perdite di prodotto e, peggio ancora, problemi di sicurezza. L’acciaio dolce, pur essendo un materiale fantastico per le sue proprietà meccaniche e il costo contenuto, è particolarmente vulnerabile.
La Minaccia Silenziosa della Corrosione
La corrosione non è un fenomeno unico. Può manifestarsi come corrosione generalizzata, ma anche in forme più insidiose come la tensocorrosione (cracking dovuto a stress e ambiente corrosivo) o la corrosione galvanica (quando metalli diversi entrano in contatto). Pensate poi ai problemi che possono sorgere negli anelli tra tubazioni e rivestimenti nei pozzi petroliferi, dove la corrosione può portare a blocchi e cedimenti strutturali. E non dimentichiamoci della corrosione indotta da microbi (MIC), causata da batteri come i fastidiosissimi batteri solfato-riduttori (SRB), che prosperano in ambienti anaerobici (senza ossigeno) come quelli che si trovano spesso nell’industria petrolifera. Insomma, un vero incubo!
Alla Ricerca di Soluzioni Efficaci ed Ecologiche
Per decenni, noi ricercatori abbiamo cercato modi per combattere questo nemico. Esistono varie strategie, come rivestimenti protettivi o modifiche dei materiali, ma una delle più efficaci ed economiche è l’uso di inibitori di corrosione. Si tratta di molecole speciali che, aggiunte in piccole quantità all’ambiente aggressivo, si “attaccano” alla superficie del metallo, formando uno strato protettivo che ne rallenta o impedisce la degradazione.
Tradizionalmente, molti inibitori erano composti sintetici, a volte poco amici dell’ambiente. La nuova frontiera, quella che mi appassiona particolarmente, è la ricerca di inibitori “verdi”, derivati da fonti naturali, biodegradabili e a bassa tossicità. Ed è qui che entra in gioco la nostra ricerca!
La Nostra Star: AEET, dall’Acido Gallico uno Scudo Potente
Abbiamo pensato: perché non sfruttare le meraviglie che la natura ci offre? L’acido gallico, una molecola presente in molte piante (come nelle galle delle querce, nel tè, ecc.), è noto per le sue proprietà antiossidanti. E se potessimo modificarlo per renderlo un super-inibitore di corrosione?
Detto, fatto! Abbiamo sintetizzato un nuovo composto, una cosiddetta base di Schiff, partendo proprio da derivati dell’acido gallico. L’abbiamo battezzato AEET (il nome chimico completo è un po’ uno scioglilingua: N-(2-{2-[2-(2-amino-etilammino)-etilammino]-etilammino}-etil)-3,4,5-triidrossi-benzammide, ma chiamiamolo AEET!). La sua struttura è ricca di atomi come ossigeno (O) e azoto (N), oltre a un anello aromatico (quello derivato dall’acido gallico), che sono noti per la loro capacità di “aggrapparsi” alle superfici metalliche. Abbiamo confermato la sua struttura usando tecniche spettroscopiche come FTIR e 1HNMR, un po’ come fare una “carta d’identità” molecolare.

AEET alla Prova del Nove: Test Elettrochimici
Ma come si comporta davvero l’AEET contro la corrosione? Per scoprirlo, abbiamo immerso campioni di acciaio dolce in una soluzione di acido cloridrico 1 M (un ambiente piuttosto aggressivo, simile a quello che si può trovare in certi processi industriali), sia senza inibitore (il nostro “bianco”, il controllo) sia con diverse concentrazioni crescenti di AEET. Abbiamo usato tecniche elettrochimiche sofisticate come la polarizzazione Tafel e la spettroscopia di impedenza elettrochimica (EIS).
Cosa abbiamo scoperto? Risultati entusiasmanti!
- L’AEET riduce drasticamente la velocità di corrosione dell’acciaio dolce.
- L’efficienza di inibizione (IE%) aumenta con la concentrazione di AEET, raggiungendo un impressionante 90.05% alla concentrazione massima testata (5 × 10⁻⁴ M). Un valore davvero notevole!
- Le misure Tafel ci hanno mostrato che l’AEET agisce sia sui processi anodici (dissoluzione del metallo) sia su quelli catodici (sviluppo di idrogeno), comportandosi come un inibitore di tipo misto. Fondamentalmente, rallenta entrambe le reazioni che causano la corrosione.
- Le misure EIS, visualizzate con i diagrammi di Nyquist (quelle specie di semicerchi), hanno confermato questi risultati. I “semicerchi” diventavano molto più grandi in presenza di AEET, indicando una maggiore resistenza al trasferimento di carica (Rct), ovvero una maggiore difficoltà per la corrosione a procedere. Abbiamo visto la Rct passare da circa 176 Ω·cm² nel bianco a ben 2593 Ω·cm² con la massima concentrazione di AEET!
- Abbiamo anche notato una diminuzione della capacità del doppio strato (Cdl), il che suggerisce che le molecole di AEET stanno effettivamente sostituendo le molecole d’acqua sulla superficie del metallo, formando uno strato protettivo più spesso e meno permissivo alla corrosione.
Uno Sguardo da Vicino: La Conferma del Microscopio
Le tecniche elettrochimiche sono potenti, ma volevamo anche “vedere” l’effetto dell’AEET. Abbiamo quindi usato un microscopio elettronico a scansione (SEM) per osservare la superficie dell’acciaio dopo 6 ore di immersione in HCl 1 M, con e senza il nostro inibitore alla concentrazione ottimale.
Le immagini parlano chiaro:
- L’acciaio immerso nell’acido senza protezione appariva ruvido, pieno di crateri e danneggiato dalla corrosione aggressiva.
- L’acciaio protetto con AEET, invece, mostrava una superficie molto più liscia e uniforme. Era evidente la formazione di un film protettivo che ha schermato efficacemente il metallo dall’attacco acido.
Questa è la prova visiva che il nostro AEET sta facendo egregiamente il suo lavoro!
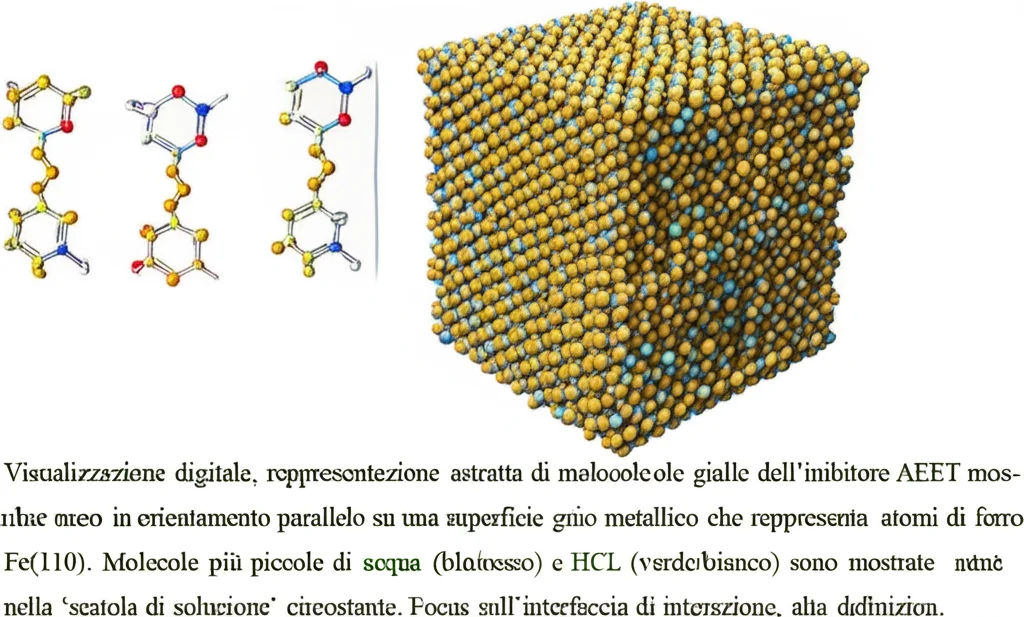
Perché Funziona Così Bene? La Teoria ci Aiuta
Ok, abbiamo visto che l’AEET funziona, ma *perché*? Qui entrano in gioco gli strumenti computazionali, che ci permettono di “zoomare” a livello molecolare e capire i meccanismi intimi dell’inibizione.
Abbiamo usato la Teoria del Funzionale della Densità (DFT) per studiare le proprietà elettroniche della molecola AEET. La DFT ci dice dove sono gli elettroni più “disponibili” (l’orbitale HOMO, Highest Occupied Molecular Orbital) e dove la molecola è più propensa ad accettare elettroni (l’orbitale LUMO, Lowest Unoccupied Molecular Orbital). Un valore alto di energia HOMO indica una buona capacità di donare elettroni (utile per legarsi al metallo), mentre un valore basso di energia LUMO indica una buona capacità di accettarli. Il nostro AEET ha mostrato ottime caratteristiche! Inoltre, il “gap” energetico tra HOMO e LUMO (ΔE) era relativamente piccolo (circa 3.2 eV), il che suggerisce una buona reattività e stabilità del legame che si forma con la superficie metallica.
Poi, siamo passati alla Dinamica Molecolare (MD). Immaginate di poter simulare al computer come le molecole di AEET si muovono e interagiscono con una superficie di ferro (Fe(110), un modello comune per l’acciaio) in presenza di acqua e ioni acidi. Le simulazioni MD ci hanno mostrato che le molecole di AEET tendono ad adsorbirsi (attaccarsi) sulla superficie del ferro disponendosi quasi parallelamente ad essa. Questo orientamento è fantastico perché permette alla molecola di coprire un’area maggiore, massimizzando la protezione. Abbiamo anche calcolato le energie di legame e interazione: i valori erano molto alti (ad esempio, l’energia di adsorbimento in fase liquida era -805.91 kJ/mol), indicando un’interazione forte e stabile tra l’inibitore e il metallo.
Infine, abbiamo usato la Funzione di Distribuzione Radiale (RDF). Questa tecnica ci dice a che distanza si trovano mediamente certi atomi da altri. Abbiamo visto che gli atomi “attivi” dell’AEET (ossigeno, azoto, carbonio dell’anello) si posizionano molto vicini (sotto i 3.5 Å) agli atomi di ferro sulla superficie, suggerendo la formazione di legami forti (chemisorbimento) oltre alle interazioni fisiche (fisisorbimento).
Non Solo Acido: AEET Combatte Anche i Microbi!
Ma non finisce qui! Ricordate la corrosione indotta da microbi (MIC) e i batteri SRB? Ci siamo chiesti: visto che l’AEET ha questa bella struttura, potrebbe funzionare anche come biocida?
Abbiamo prelevato campioni di acqua da un impianto petrolifero egiziano, noti per essere “infestati” da SRB. Abbiamo preparato delle colture in condizioni anaerobiche (simulando l’ambiente reale) e abbiamo aggiunto diverse concentrazioni di AEET. Abbiamo seguito la crescita batterica per 21 giorni a 40 °C, usando un metodo standard (NACE TM0194-14-SG).
I risultati? Sorprendenti!
- Nei campioni di controllo (senza AEET), i batteri SRB sono proliferati abbondantemente (lo si vede dalla formazione di un precipitato nero di solfuro di ferro).
- Nei campioni trattati con AEET, la crescita batterica è stata drasticamente ridotta. Alla concentrazione di 1 × 10⁻⁴ M, il numero di cellule batteriche era bassissimo (10² cellule/ml), e alla concentrazione di 2 × 10⁻⁴ M, la crescita è stata completamente inibita (0 cellule/ml)!
Questo significa che il nostro AEET non è solo un ottimo inibitore di corrosione chimica, ma anche un potente biocida contro gli SRB, rendendolo un candidato ideale per combattere la MIC.

Il Segreto dell’Azione Biocida: Docking Molecolare
Come fa l’AEET a fermare i batteri? Ancora una volta, la simulazione ci viene in aiuto con il docking molecolare. Questa tecnica è come cercare di capire se una chiave (la nostra molecola AEET) si adatta bene a una serratura (una proteina essenziale per la vita del batterio).
Abbiamo selezionato le strutture tridimensionali di alcune proteine chiave di batteri spesso coinvolti in problemi industriali (come *Aspergillus fumigatus*, *Geotrichum candidum*, *Streptococcus pneumoniae*, *Escherichia coli* – quest’ultima spesso usata come modello). Abbiamo simulato al computer come la molecola AEET si “incastra” nei siti attivi di queste proteine.
I risultati del docking hanno mostrato che l’AEET si lega molto bene a queste proteine batteriche, ottenendo ottimi “punteggi” di affinità (fino a -8.5 kcal/mol) e formando legami idrogeno specifici con amminoacidi cruciali nei siti attivi. In pratica, l’AEET agisce come una chiave che blocca la serratura, impedendo alla proteina batterica di funzionare correttamente e, di conseguenza, ostacolando la vita del microbo. Questo spiega la sua potente attività biocida osservata negli esperimenti.
Conclusioni: Un Futuro Più Verde e Sicuro per l’Acciaio
Quindi, cosa abbiamo imparato da questa avventura scientifica? Abbiamo sviluppato e testato a fondo un nuovo composto, l’AEET, derivato dall’acido gallico. Si è dimostrato un eccellente inibitore di corrosione per l’acciaio dolce in ambiente acido (HCl 1 M), con efficienze superiori al 90%. Ma non solo: è anche un potente biocida contro i batteri SRB, responsabili della corrosione microbiologica.
La cosa più bella è che l’AEET è un composto “verde”, derivato da una fonte naturale, il che lo rende una soluzione molto più sostenibile rispetto a molti inibitori tradizionali. L’integrazione tra esperimenti di laboratorio (elettrochimica, SEM, test microbiologici) e simulazioni computazionali (DFT, MD, docking) ci ha permesso non solo di dimostrare la sua efficacia, ma anche di capire *perché* funziona così bene a livello molecolare.
Crediamo che l’AEET rappresenti un passo avanti significativo nella protezione dei materiali metallici, offrendo una soluzione multifunzionale, ecologica ed economicamente vantaggiosa per combattere sia la corrosione chimica che quella microbiologica. Il futuro della protezione dei materiali potrebbe essere davvero più verde!
Fonte: Springer







